Asam Sulfat – Pengertian, Sifat, Rumus, Bahaya dan Proses – DosenPendidikan.Com – Untuk pembahasan kali ini kami akan memberikan ulasan mengenai Asam Sulfat yang dimana dalam hal ini meliputi, pengertian, sifat, rumus, bahaya dan proses. Nah agar lebih dapat memahami dan mengerti simak ulasan selengkapnya dibawah ini.
Asam sulfat adalah asam mineral (zat anorganik) yang sangat kuat. Zat ini larut di dalam air. Asam Sulfat memiliki rumusan kimia H2SO4, dan memiliki massa molar sebesar 98,08 g / mol. Asam sulfat berpenampilan seperti cairan Higroskopis, berminyak, tak bewarna, dan tak berbau.
Asam sulfat murni yang tidak diencerkan tidak dapat ditemukan secara alami di bumi oleh karena sifatnya yang higroskopis. Walaupun demikian, asam sulfat merupakan komponen utama hujan asam, yang terjadi karena oksidasi sulfur dioksida di atmosfer dengan keberadaan air (oksidasi asam sulfit).
Asam sulfat terbentuk secara alami melalui oksidasi mineral sulfida, misalnya besi sulfida. Air yang dihasilkan dari oksidasi ini sangat asam dan disebut sebagai air asam tambang.
Besi (III) atau ion feri juga dapat mengoksidasi pirit. Ketika oksidasi pirit besi(III) terjadi, proses ini akan berjalan dengan cepat. Nilai pH yang lebih rendah dari nol telah terukur pada air asam tambang yang dihasilkan oleh proses ini.
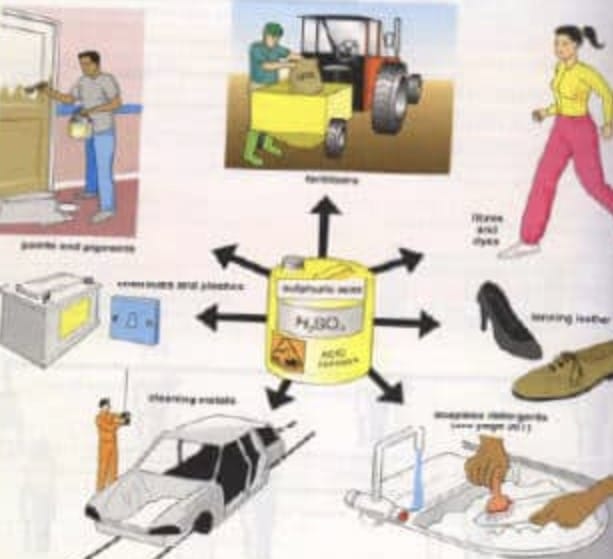
Berikut ini terdapat beberapa fungsi dari asam sulfat, antara lain:
- Pupuk
- Kilang minyak
- Serabut buatan
- Bahan kimia industri
- Plastik
- Pharmasi
- Baterai
- Bahan ledak
Rumus Kimia Asam Sulfat
Asam sulfat memiliki rumus kimia H2SO4, berdasarkan dari rumus kimianya, asam sulfat ini dibentuk dari komponen kation asam (H+) serta komponen anion sulfat (SO42-). Melihat rumus kimia asam sulfat tersebut, proses pembuatan asam sulfat memang tak semudah yang dibayangkan.
Sebut saja ekstraksi belerang dari batunya, konversi belerang sampai menjadi belerang dioksida, konversi belerang dioksida hingga menjadi belerang trioksida dan juga konversi belerang trioksida menjadi asam sulfat.
Sifat-Sifat Asam Sulfat
Berikut ini terdapat dua sifat asam sulfat, antara lain:
Sifat Kimia Asam Sulfat
- REAKSI DENGAN AIR
Reaksi hidrasi asam sulfat sangatlah eksotermik. Selalu tambahkan asam ke dalam air daripada air ke dalam asam. Air memiliki massa jenis yang lebih rendah daripada asam sulfat dan cenderung mengapung di atasnya, sehingga apabila air ditambahkan ke dalam asam sulfat pekat, ia akan dapat mendidih dan bereaksi dengan keras. Reaksi yang terjadi adalah pembentukan ion hidronium, antara lain:
H2SO4 + H2O → H3O+ + HSO−4
HSO−4 + H2O → H3O+ + SO2−4
Karena hidrasi asam sulfat secara termodinamika difavoritkan, asam sulfat adalah zat pendehidrasi yang sangat baik dan digunakan untuk mengeringkan buah-buahan. Afinitas asam sulfat terhadap air cukuplah kuat sedemikiannya ia akan memisahkan atom hidrogen dan oksigen dari suatu senyawa. Sebagai contoh, mencampurkan pati (C6H12O6)n dengan asam sulfat pekat akan menghasilkan karbon dan air yang terserap dalam asam sulfat (yang akan mengencerkan asam sulfat), antara lain:
(C6H12O6)n → 6n C + 6n H2O
Efek ini dapat dilihat ketika asam sulfat pekat diteteskan ke permukaan kertas. Selulosa bereaksi dengan asam sulfat dan menghasilkan karbon yang akan terlihat seperti efek pembakaran kertas. Reaksi yang lebih dramatis terjadi apabila asam sulfat ditambahkan ke dalam satu sendok teh gula. Seketika ditambahkan, gula tersebut akan menjadi karbon berpori-pori yang mengembang dan mengeluarkan aroma seperti karamel.
- BEREAKSI DENGAN BASA
Sebagai asam, asam sulfat bereaksi dengan kebanyakan basa, menghasilkan garam sulfat.
Sebagai contoh, garam tembaga tembaga(II) sulfat dibuat dari reaksi antara tembaga(II) oksida dengan asam sulfat:
CuO + H2SO4 → CuSO4 + H2O
Asam sulfat juga dapat digunakan untuk mengasamkan garam dan menghasilkan asam yang lebih lemah. Reaksi antara natrium asetat dengan asam sulfat akan menghasilkan asam asetat, CH3COOH, dan natrium bisulfat, antara lain:
H2SO4 + CH3COONa → NaHSO4 + CH3COOH
Hal yang sama juga berlaku apabila mereaksikan asam sulfat dengan kalium nitrat. Reaksi ini akan menghasilkan asam nitrat dan endapat kalium bisulfat. Ketika dikombinasikan dengan asam nitrat, asam sulfat berperilaku sebagai asam sekaligus zat pendehidrasi, membentuk ion nitronium NO2+, yang penting dalam reaksi nitrasi yang melibatkan substitusi aromatik elektrofilik. Reaksi jenis ini sangatlah penting dalam kimia organik.
- BEREAKSI DENGAN LOGAM
Asam sulfat bereaksi dengan kebanyakan logam via reaksi penggantian tunggal, menghasilkan gas hidrogen dan logam sulfat. H2SO4 encer menyerang besi, aluminium, seng, mangan, magnesium dan nikel.
Namun reaksi dengan timah dan tembaga memerlukan asam sulfat yang panas dan pekat. Timbal dan tungsten tidak bereaksi dengan asam sulfat. Reaksi antara asam sulfat dengan logam biasanya akan menghasilkan hidrogen seperti yang ditunjukkan pada persamaan di bawah ini. Namun reaksi dengan timah akan menghasilkan sulfur dioksida daripada hidrogen.
Fe (s) + H2SO4 (aq) → H2 (g) + FeSO4 (aq)
Sn (s) + 2 H2SO4 (aq) → SnSO4 (aq) + 2 H2O (l) + SO2 (g)
Hal ini dikarenakan asam pekat panas umumnya berperan sebagai oksidator, manakala asam encer berperan sebagai asam biasa. Sehingga ketika asam pekat panas bereaksi dengan seng, timah, dan tembaga, ia akan menghasilkan garam, air dan sulfur dioksida, manakahal asam encer yang beraksi dengan logam seperti seng akan menghasilkan garam dan hidrogen.
- ASAM SULFAT SEBAGAI AGEN SULFONASI
asam sulfat pekat dipergunakan dalam kimia organik untuk menggantikan suatu atom hidrogen oleh gugus asam sulfonat.
H2SO4 + CH3C6H5à CH3C6H5SO3 +H2O
Asam sulfat menjalani reaksi substitusi aromatik elektrofilik dengan senyawa-senyawa aromatik, menghasilkan asam sulfonat terkait.
- ASAM SULFAT SEBAGAI DEHIDRATOR
asam sulfat yang pekat akan menarik unsur-unsur pembentuk air dari sejumlah senyawaan. Sebagai contoh, gula akan dikonversi menjadi karbon dan air. reaksi merupakan reaksi eksotermis yang spektakuler.
- ASAM SULFAT SEBAGAI OKSIDATOR
Memang asam sulfat bukanlah oksidator sekuat asam nitrat. Sifat oksidatornya baru muncul jika dalam suasan pekat dan panas. Jadi, jika ada soal mengenai reaksi dengan asam sulfat, maka berhati-hatilah. Anda harus melihat kondisinya, kalau encer, maka reaksinya akan seperti reaksi-reaksi asam biasa. Jika pekat, maka reaksinya sudah meningkat menjadi reaksi REDOKS.
Sifat Fisika Asam Sulfat
- BENTUK-BENTUK ASAM SULFAT
Walaupun asam sulfat yang mendekati 100% dapat dibuat, ia akan melepaskan SO3 pada titik didihnya dan menghasilkan asam 98,3%. Asam sulfat 98% lebih stabil untuk disimpan, dan merupakan bentuk asam sulfat yang paling umum.
Asam sulfat 98% umumnya disebut sebagai asam sulfat pekat. Terdapat berbagai jenis konsentrasi asam sulfat yang digunakan untuk berbagai keperluan:
- 10%, asam sulfat encer untuk kegunaan laboratorium,
- 33,53%, asam baterai,
- 62,18%, asam bilik atau asam pupuk,
- 73,61%, asam menara atau asam glover,
- 97%, asam pekat.
Terdapat juga asam sulfat dalam berbagai kemurnian. Mutu teknis H2SO4 tidaklah murni dan seringkali berwarna, namun cocok untuk digunakan untuk membuat pupuk. Mutu murni asam sulfat digunakan untuk membuat obat-obatan dan zat warna.
Apabila SO3(g) dalam konsentrasi tinggi ditambahkan ke dalam asam sulfat, H2S2O7 akan terbentuk. Senyawa ini disebut sebagai asam pirosulfat, asam sulfat berasap, ataupun oleum.
Konsentrasi oleum diekspresikan sebagai %SO3 (disebut %oleum) atau %H2SO4 (jumlah asam sulfat yang dihasilkan apabila H2O ditambahkan); konsentrasi yang umum adalah 40% oleum (109% H2SO4) dan 65% oleum (114,6% H2SO4). H2S2O7 murni terdapat dalam bentuk padat dengan titik leleh 36 °C.
- POLARITAS DAN KONDUKTIVITAS
H2SO4 anhidrat adalah cairan yang sangat polar. Ia memiliki tetapan dielektrik sekitar 100. Konduktivitas listriknya juga tinggi. Hal ini diakibatkan oleh disosiasi yang disebabkan oleh swa-protonasi, disebut sebagai autopirolisis.
2 H2SO4 → H3SO+4 + HSO−4
Konstanta kesetimbangan autopirolisisnya adalah :
Kap(25 °C)= [H3SO+4][HSO−4] = 2,7 × 10−4.
Dibandingkan dengan konstanta keseimbangan air, Kw = 10−14, nilai konstanta kesetimbangan autopirolisis asam sulfat 1010 (10 triliun) kali lebih kecil.
Walaupun asam ini memiliki viskositas yang cukup tinggi, konduktivitas efektif ion H3SO+4 dan HSO−4
tinggi dikarenakan mekanisme ulang alik proton intra molekul, menjadikan asam sulfat sebagai konduktor yang baik. Ia juga merupakan pelarut yang baik untuk banyak reaksi.
Kesetimbangan kimiawi asam sulfat sebenarnya lebih rumit daripada yang ditunjukkan di atas; 100% H2SO4 mengandung beragam spesi dalam kesetimbangan (ditunjukkan dengan nilai milimol per kg pelarut), antara lain:
HSO−4 (15,0), H3SO+4 (11,3), H3O+ (8,0), HS2O−7(4,4), H2S2O7 (3,6), H2O (0,1).
Reaksi Asam Sulfat
Berikut ini terdapat beberapa reaksi asam sulfat, antara lain sebagai berikut:
- Reaksi dengan halogen
NaCI + H2SO4 >> NaHSO4 + HCI - Reaksi pembentukan asam fosfat untuk idustri alumunium fosfat
Ca5F(PO4) + 5 H2SO4 + 10 H20 >> 5 CaSO42H2O + HF + 3 H3PO4 - Reaksi dengan logam
Fe(S) + H2SO4(aq) >> H2(g) + FeSO4(aq) - Reaksi dengan air membentuk larutan asam kuat
H2SO4 + H2O >> H3O+ + HSO4– - Reaksi dengan non logam
C + 2 H2SO4 >> CO2 + 2 SO2 + 2 H2O
Bahaya Asam Sulfat
Asam sulfat atau sulphuric acid adalah asam mineral kuat tak berwarna dengan sifat korosif yang tinggi. Asam sulfat dapat larut dalam air dalam berbagai perbandingan.
Asam sulfat sangat berbahaya bila terkena jaringan kulit karena sifatnya yang korosif, dan dengan sifatnya sebagai penarik air yang kuat (pendehidrasi) akan menimbulkan luka seperti luka bakar pada jaringan kulit.
Semakin tinggi konsentrasi asam sulfat semakin bertambah bahayanya. Walaupun asam sulfat tersebut encer, akan tetap mampu mendehidrasi kertas jika tetesan asam sulfat dibiarkan di kertas dalam waktu lama.
Asam sulfat dianggap tidak beracun selain bahaya korosifnya. Risiko utama asam sulfat adalah kontak dengan kulit yang menyebabkan luka bakar dan penghirupan aerosol asap.
Paparan dengan aerosol asam pada konsentrasi tinggi akan menyebabkan iritasi mata, saluran pernapasan, dan membran mukosa yang parah. Iritasi akan mereda dengan cepat setelah paparan, walaupun terdapat risiko edema paru apabila kerusakan jaringan lebih parah.
Pada konsentrasi rendah, simtom-simtom akibat paparan kronis aerosol asam sulfat yang paling umumnya dilaporkan adalah pengikisan gigi. Indikasi kerusakan kronis saluran pernapasan masih belum jelas. Di Amerika Serikat, batasan paparan yang diperbolehkan ditetapkan sebagai 1 mg/m³. Terdapat pula laporan bahwa penelanan asam sulfat menyebabkan defisiensi vitamin B12 dengan degenarasi gabungan subakut.
Selain itu, asam sulfat pekat atau biasa disebut oleum pun berbahaya. Oleum akan menghasilkan gas SO2 yang sangat reaktif yang jika terhirup, akan merusak paru-paru. Untuk pertolongan pertama jika terhirup, segera cari udara segar dan segera cari pertolongan medis.
Langkah yang harus dilakukan jika terkena asam sulfat adalah, guyur bagian tubuh yang terpapar asam sulfat dengan air yang mengalir selama 10-15 menit.
Hal ini bertujuan untuk mendinginkan jaringan disekitar luka bakar asam, dan untuk mencegah adanya kerusakan sekunder. Pakaian yang terkena asam sulfat pun juga harus segera di lepas, dan guyur dengan air kulit yang terkena asam sulfat lewat pakaian tersebut.
Jika terpapar asam sulfat pada mata, segera guyur mata dengan air hangat selama 20 menit, dan segera pergi ke dokter.
Kehati-hatian sangat diperlukan dalam menangani asam sulfat. sangat disarankan untuk memakai peralatan-peralatan keamanan, antara lain:
- KACAMATA PELINDUNG

Kacamata pelindung berfungsi melindungi mata dari berbagai kemungkinan terkena percikan asam sulfat ke mata.
- SAFETY GOGGLE / PELINDUNG MUKA
Safety goggle mencegah tumpahan ataupun percikan asam sulfat ke muka
- SARUNG TANGAN POLIETILEN
Sarung tangan polietilen berfungsi melindungi tangan saat menangani asam sulfat.
Proses Pembuatan Asam Sulfat
Pembuatan asam sulfat dapat dilakukan dengan 2 cara, yaitu proses bilik timbal dan proses kontak. Akan tetapi, proses bilik timbal sudah banyak ditinggalkan karena tidak terlalu menguntungkan. Proses kontak lebih dipilih karena dapat menghasilkan asam sulfat dengan kadar mencapai 99% dengan biaya yang lebih murah.
A. PROSES KONTAK
Proses pembuatan asam sulfat berlangsung dalam 3 tahap, antara lain:
- Ekstraksi belerang
Sumber dari belerang paling banyak berasal dari recovery gas alam dan minyak. Minyak dan gas alam banyak mengandung senyawa sulfur, baik dalam bentuk organik maupun hidrogen sulfida yang kedua senyawa tersebut harus dihilangkan sebelum minyak bumi digunakan sebagai bahan bakar atau bahan baku kimia.
Sumber penting lain dari sulfur adalah belerang dioksida dari pemurnian logam. Banyak bijih logam mengandung sulfida dan dipanaskan untuk membentuk oksida sebagai sulfur dioksida, misalnya, dalam pembuatan timbal.
Logam lainnya yang diproduksi dari bijih sulfida adalah tembaga, nikel dan seng. Di seluruh dunia sekitar 35% belerang diperoleh dari sulfur dioksida yang berasal dari pemanasan bijih sulfida dan ini terus meningkat, pada umumnya pabrik-pabrik melepaskans sulfur dioksida ke atmosfer dan didaur ulang sebagai asam sulfat.
Secara khusus, China membuat sebagian besar asam sulfat dari pirit, yaitu bijih besi sulfida. Asam sulfat juga diperoleh dari amonium sulfat, produk samping dalam pembuatan poli (metil 2-methylpropenoate) dan juga dari daur ulang asam sulfat yang telah di gunakan.
Jika bahan bakunya adalah belerang sulfur, maka terlebih dahulu harus dikonversi menjadi belerang dioksida. Belerang cair disemprotkan ke tungku dan dibakar dalam ledakan udara kering pada sekitar 1300 K. belerang akan terbakar yang ditandai dengan warna api biru.
Udara yang berlebih terdiri 10-12% sulfur dioksida dan 10% oksigen. Gas-gastersebut sangat panas dan begitu juga melewati penukar panas (waste heat boiler).
Gas didinginkan sampai sekitar 700 K dan air di pipa boiler sekitarnya diubah menjadi uap. Dalam pembuatan satu ton asam sulfat, diproduksi satu ton uap tekanan tinggi.
- Konversi dari belerang dioksida ke sulfur trioksida (Proses Kontak)
Sebuah pabrik khas berisi satu saluran silinder yang bertindak sebagai fixed bad reactor dengan empat tempat bed dipisahkan dengan katalis atau yang dikenal sebagai konverter, kemudian dipanaskan sampai 700 K, sebagai saluran untuk keluarnya belerang oksida dan udara.
Katalis, vanadium (V) oksida pada silika umumnya dalam bentuk pelet kecil, dan ditambahkan cesium sulfat pada permukaanya (Gambar bawah). Fungsi cesium sulfat ini adalah untuk menurunkan titik leleh vanadium (V) oksida sehingga cair pada 700 K. Katalis Vanadium oksida (V2O5) digunakan untuk pembuatan asam sulfat.
Gambar diagram proses kontak dapat dilihat pada gambar diatas, Sebuah diagram alir Proses Kontak. Seperti ditunjukkan di atas, itu adalah reaksi eksotermis sehingga, untuk hasil yang memuaskan dari sulfur trioksida (di atas 99,5% diperlukan konversi), digunakan suhu rendah agar seekonomis mungkin.
Dengan demikian, panas dipindahkan dengan melepaskan gas dari setiap bed dengan menggunakan penukar panas. Sulfur trioksida yang dihasilkan dipindahkan antara bed ketiga dan keempat dan mengalir ke tahap selanjutnya, yaitu konversi sulfur trioksida untuk asam sulfat.
Namun, sejumlah kecil sulfur dioksida tidak dikonversi dan melewati keempat katalis bed dan menghasilkan gas, terutama sulfur trioksida yang mengalir ke tahap berikutnya.
- Konversi dari sulfur trioksida untuk asam sulfat
Belerang trioksida yang terbentuk dari bed ketiga (dan sejumlah kecil dari bed keempat) sekarang dikonversi ke asam sulfat. Sulfur trioksida bereaksi dengan air dan reaksi dapat dinyatakan sebagai:
Namun, air itu sendiri tidak dapat digunakan untuk penyerapan karena ada kenaikan suhu yang besar, dan terbentuk kabut asam sulfat, yang sulit untuk di tangani.
Sebaliknya, digunakan asam sulfat dengan konsentrasi sekitar 98%. kemudian disimpan pada konsentrasi tersebut dengan penambahan air dan penghilangan asam pada konsentrasi ini. Untuk menjaga suhu di sekitar 400 K, panas dihilangkan dengan penukar panas.
Gas yang tidak diserap mengandung sekitar 95% nitrogen, 5% oksigen, dan sisa sulfur dioksida. Aliran gas disaring untuk menghilangkan sisa kabut asam sulfat dan dikembalikan ke atmosfer dengan menggunakan cerobong tinggi.
Tahapan yang paling menentukan pada proses pembuatan asam sulfat adalah tahapan pembentukan SO3 dari SO2. Reaksi pembentukan SO3 dari SO2 adalah reaksi reversible, sehingga untuk meningkatkan produknya dilakukan usaha-usaha berdasarkan asas Le Chatelier.
Berdasarkan jumlah koefisien reaksi pada pembentukan SO3, untuk meningkatkan produknya, proses harus dilakukan pada tekanan tinggi.
Selain itu, karena reaksi pembentukan SO3 adalah reaksi eksotermis, maka untuk meningkatkan produknya, proses harus dilakukan pada suhu rendah. Akan tetapi, pada suhu rendah reaksi berlangsung lambat, sehingga ke dalam reaksi perlu ditambahkan katalis V2O5.
Sama halnya dengan proses pembuatan amonia, percobaan terus dilakukan untuk memperoleh kondisi optimum. Berdasarkan berbagai percobaan, kondisi optimum untuk proses pembuatan asam sulfat dalam skala industri berlangsung pada suhu antara 400oC– 450oC dan tekanan 1 atm. Hasil yang diperoleh melalui proses ini adalah H2SO4 dengan kadar 97%–99%.
B. PROSES BILIK TIMBAL
Pembuatan asam sulfat Bahan baku pada proses ini adalah SO2, sama dengan proses kontak. Perbedaannya terdapat pada Katalis yang digunakan, Katalis yang digunakan pada proses ini adalah gas NO dan NO2. Gas SO2, NO, NO2, dan uap air dialirkan ke dalam ruang yang bagian dalamnya dilapisi Pb (timbal).
Gas SO2 hasil pemanggangan dialirkan ke dalam menara glover bersama asam nitrat. Dalam hal ini asam nitrat diurai menjadi NO dan NO2. Campuran gas tersebut dialirkan ke dalam bilik timbal bersama-sama udara dan uap air hingga terjadi reaksi.
Reaksi:
2 SO2 + O2 + NO + NO2 + H2O →2 HNOSO4 (asam nitrosil)
Asam nitrosil (HNOSO4) bereaksi dengan H2O membentuk asam sulfat (H2SO4).
Reaksi:
2 HNOSO4 + H2O→2 H2SO4 + NO + NO2
Gas NO dan NO2 dialirkan ke menara Gay Lussac kemudian diubah menjadi HNO3. Sedangkan asam nitrat akan dialirkan kembali ke menara glover dan seterusnya. Asam sulfat yang terbentuk akan dialirkan ke bak penampungan.
Kegunaan Asam Sulfat
Asam sulfat merupakan komoditas kimia yang sangat penting, dan sebenarnya pula, produksi asam sulfat suatu negara merupakan indikator yang baik terhadap kekuatan industri negara tersebut.
Kegunaan utama (60% dari total produksi di seluruh dunia) asam sulfat adalah dalam “metode basah” produksi asam fosfat, yang digunakan untuk membuat pupukfosfat dan juga trinatrium fosfat untuk deterjen. Pada metode ini, batuan fosfat digunakan dan diproses lebih dari 100 juta ton setiap tahunnya.
Bahan-bahan baku yang ditunjukkan pada persamaan di bawah ini merupakan fluorapatit, walaupun komposisinya dapat bervariasi. Bahan baku ini kemudian diberi 93% asam suflat untuk menghasilkan kalsium sulfat, hidrogen fluorida (HF), dan asam fosfat. HF dipisahan sebagai asam fluorida. Proses keseluruhannya dapat ditulis:
Ca5F(PO4)3 + 5 H2SO4 + 10 H2O → 5 CaSO4•2 H2O + HF + 3 H3PO4
Asam sulfat digunakan dalam jumlah yang besar oleh industri besi dan baja untuk menghilangkan oksidasi, karat, dan kerak air sebelum dijual ke industri otomobil. Asam yang telah digunakan sering kali didaur ulang dalam kilang regenerasi asam bekas (Spent Acid Regeneration (SAR) plant).
Kilang ini membakar asam bekas dengan gas alam, gas kilang, bahan bakar minyak, ataupun sumber bahan bakar lainnya. Proses pembakaran ini akan menghasilkan gas sulfur dioksida (SO2) dan sulfur trioksida (SO3) yang kemudian digunakan untuk membuat asam sulfat yang “baru”.
Amonium sulfat, yang merupakan pupuk nitrogen yang penting, umumnya diproduksi sebagai produk sampingan dari kilang pemroses kokas untuk produksi besi dan baja. Mereaksikan amonia yang dihasilkan pada dekomposisi termal batu bara dengan asam sulfat bekas mengizinkan amonia dikristalkan keluar sebagai garam (sering kali berwarna coklat karena kontaminasi besi) dan dijual kepada industri agrokimia.
Kegunaan asam sulfat lainnya yang penting adalah untuk pembuatan aluminium sulfat. Alumunium sulfat dapat bereaksi dengan sejumlah kecil sabun pada serat pulp kertas untuk menghasilkan aluminium karboksilat yang membantu mengentalkan serat pulp menjadi permukaan kertas yang keras. Aluminium sulfat juga digunakan untuk membuat aluminium hidroksida.
Aluminium sulfat dibuat dengan mereaksikan bauksit dengan asam sulfat:
Al2O3 + 3 H2SO4 → Al2(SO4)3 + 3 H2O
Asam sulfat juga memiliki berbagai kegunaan di industri kimia. Sebagai contoh, asam sulfat merupakan katalis asam yang umumnya digunakan untuk mengubah sikloheksanonoksim menjadi kaprolaktam, yang digunakan untuk membuat nilon. Ia juga digunakan untuk membuat asam klorida dari garam melalui proses Mannheim.
Banyak H2SO4 digunakan dalam pengilangan minyak bumi, contohnya sebagai katalis untuk reaksi isobutana dengan isobutilena yang menghasilkan isooktana.
Dalam Industri
- Asam sulfat digunakan pada proses pembuatan deterjen.
- Industri pembuatan HNO3 atau asam nitrat juga menggunakan asam kuat yang satu ini.
- Pada pembuata betere untuk industri otomotif juga menggunakan asam sulfat sebagai larutan elektrolit.
- Asam sulfat digunakan dalam proses penghilangan zat-zat pengotor dari minyak bumi pada proses penylingan minyak bumi.
- Asam sulfat digunakan sebagai bahan baku dalam proses pembuatan pupuk superfosfat dan amonium sulfat.
- Pada proses pembuatan bahan peledak, nitrogliserin, asam sulfat digunakan sebagai salah satu reaktan.
- Selain biasa menggunakan asam klorida untuk meregenerasi kation resin, pada unit pembuatan air bebas mineral, juga dapat digunakan asam sulfat.
- Proses pembuatan rayon juga menggunakan asam sulfat, setelah dicampur dengan tetra amine copper (II), serat selulosa kayu direaksikan dengan asam sulfat untuk menghasilkan serat rayon.
- Asam kuat yang satu ini juga dipergunakan sebagai bahan pembuat bahan perekat atau lem.
- Asam sulfat biasa digunakan sebagai salah satu chemical reagent di laboratorium analisa.
- Pada proses pembuatan bahan pewarna, asam sulfat juga digunakan.
- Asam sulfat dimanfaatkan sebagai bahan kimia pada proses water treatment untuk pengaturan keasaman atau pH adjustment. Dibandingkan dengan asam klorida, penggunaan asam sulfat lebih disukai. Hal ini dikarenakan asam klorida bisa mengakibatkan korosi pada perpipaan atau peralatan dari stainless steel.
- Asam sulfat berperan pada proses cleaning (pickling) pada proses pengolahan logam-besi dan baja-sebelum logam melalui proses plating dengan seng atau timah.
Dalam Kehidupan Sehari-hari
- Sebagai cairan elektrolit aki
- Bahan pembuat pupuk.
- Rumus kimia asam sulfat juga memungkinkannya berguna sebagai pembersih karat.
Demikianlah pembahasan mengenai Asam Sulfat – Pengertian, Sifat, Rumus, Bahaya dan Proses semoga dengan adanya ulasan tersebut dapat menambah wawasan dan pengetahuan kalian semua,, terima kasih banyak atas kunjungannya.
Baca Juga: